넥스트 팬데믹을 대비하는 신종 코로나바이러스
고속 약물 스크리닝 플랫폼 개발
다가올 팬데믹 상황에 발 빠르게 대응하여 효과적인 치료제 개발에 도움 줄 것
윤대성 교수 연구팀, 저명 학술지 ‘Nature Communications’ 게재

▲ (왼쪽부터) 윤대성 교수(교신저자, 고려대), 정효기(공동 제1저자, 고려대 석·박통합과정),
이동택 박사(공동 제1저자, Harvard Medical School),
박동성 박사(공동 제1저자, 전 고려대, 현 Brookhaven National Laboratory),
황교선 교수(교신저자, 경희대), 이정훈 교수(교신저자, 광운대)
바이오의공학과 윤대성 교수 연구팀은 인공적으로 합성한 엔지니어드 아밀로이드 펩타이드를 이용하여 새로 출현할 신종 코로나바이러스의 생존 및 증식에 필수적인 주요 단백질 분해효소(main protease, Mpro)의 활성을 억제하는 약물의 효능을 고속으로 확인할 수 있는 코로나바이러스 치료제 스크리닝 플랫폼을 개발했다.
이번 연구 결과는 저명 학술지인 ‘Nature Communications’(IF=16.6)에 3월 8일 자 온라인 게재됐다.
- 논문명 : Bioengineered amyloid peptide for rapid screening of inhibitors against main protease of SARS-CoV-2
- 논문URL : https://www.nature.com/articles/s41467-024-46296-7
본 연구 성과는 앞으로 다가올 넥스트 팬데믹 상황에 발 빠르게 대응하여 효과적인 치료제를 조기에 개발하는 데 핵심적인 도움을 줄 것으로 기대된다. COVID-19 팬데믹을 일으킨 코로나바이러스는 스파이크 단백질의 변이(델타, 오미크론)가 기존 백신의 효과 무력화시켜 COVID-19 치료제 개발에 대한 긴급한 수요가 존재하게 됐다.
현재, COVID-19 치료를 위해 ▲코로나바이러스의 스파이크 단백질 타깃 중화항체 ▲바이러스 RNA 타깃 약물 ▲코로나바이러스 유래 단백질 분해 효소를 타깃으로 약물이 개발되고 있다. 이때, 스파이크 단백질의 잦은 변이에 의해 중화항체의 효능은 계속 감소하며, 바이러스 RNA 타깃 약물의 경우 인간의 RNA에도 작용하여 유전체 손상 및 유전병 등을 일으키는 부작용이 있다. 따라서, 이러한 단점 및 부작용이 없는 코로나바이러스 유래 단백질 분해 효소(Mpro)를 타깃으로 하는 약물의 발굴이 중요한 시점이며, 현재 COVID-19 바이러스 감염이 확인된 환자에게 처방되는 화이자사의 Paxlovid도 Mpro의 활성을 억제하는 메커니즘으로 작동하는 치료제이다.
바이러스 유래 단백질 분해효소를 타깃하는 약물은 코로나바이러스 복제에 관여하는 바이러스 유래 단백질 분해효소 Mpro(The Main Protease of SARS-CoV-2)의 활성을 억제하여 바이러스의 증식을 억제하는 방식이다.(그림 1) Mpro에 의한 바이러스 복제기작은 다양한 종류의 코로나바이러스(SARS-CoV, MERS-CoV, HCoV-HKU1 등)들이 그 메커니즘을 공유하고 있다.
2003년에 행한 SARS-CoV-1의 Mpro 활성 부위 서열과 2021년 SARS-CoV-2의 Mpro 활성 부위 서열을 비교할 때 20년이 지났음에도 변이가 전무하다. 넥스트 팬데믹(COVID-X) 상황에서 출현할 신종 코로나바이러스의 경우도 유사한 Mpro가 바이러스의 증식에 핵심적으로 이용될 가능성이 높다. 따라서 변화가 거의 없는 Mpro 활성 부위를 타깃으로 한 약제의 경우, 인체에 대한 부작용이 적고 미래에 발생할 수 있는 COVID-X에도 치료제로써 높은 효능을 유지할 것으로 예상된다.
<그림 설명_1>

▲ 코로나 바이러스 생활사 및 Mpro-억제제 작용 메커니즘
본 연구팀은 Mpro 억제제의 효능을 모니터링하여 코로나바이러스 치료제를 스크리닝할 수 있는 플랫폼을 개발하기 위해 엔지니어드 아밀로이드 펩타이드를 이용했다. ‘그림 2’와 같이 프리온 단백질 유래 아밀로이드 서열(GNNQQNY)과 Mpro에 의해 절단되는 서열(LQS)을 융합하여 엔지니어드 아밀로이드 펩타이드(MCAP, Mpro cleavage-site-embedded amyloid peptide)를 합성했다. 엔지니어드 아밀로이드 펩타이드의 경우 아밀로이드 서열에 의해 아밀로이드 성질을 가짐으로 서로 응집되는 특성이 있으며, Mpro 절단 서열에 의해 Mpro에 의해 분해되는 성질을 가지고 있다.
<그림 설명_2>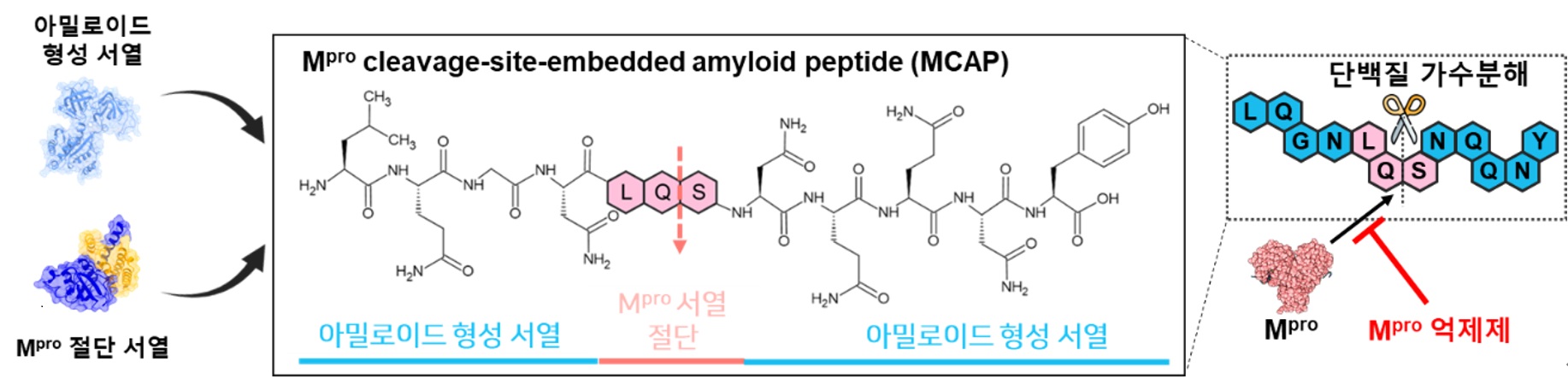
▲ 엔지니어드 아밀로이드 펩타이드 합성 모식도
본 연구팀은 엔지니어드 아밀로이드 펩타이드를 금 나노입자 표면에 코팅하여 엔지니어드 아밀로이드 나노복합체를 합성했다.(그림 3a) 나노복합체가 Mpro와 반응할 경우 엔지니어드 아밀로이드 내부의 Mpro 절단 서열에 의해 금 나노입자 표면에서 단백질 응집체가 분해되어 떨어져 나가게 된다. 이에 따라 입자의 안정성이 감소하여 응집되며, 금 나노입자의 광학적 성질에 의해 용액의 색 변화가 일어난다. 이때, Mpro 억제제와 반응한 Mpro는 활성이 떨어져 용액의 색 변화를 일으키는 정도가 달라지며, 용액의 색 변화를 통하여 Mpro 억제제의 활성을 정량적으로 측정할 수 있다.
<그림 설명_3>
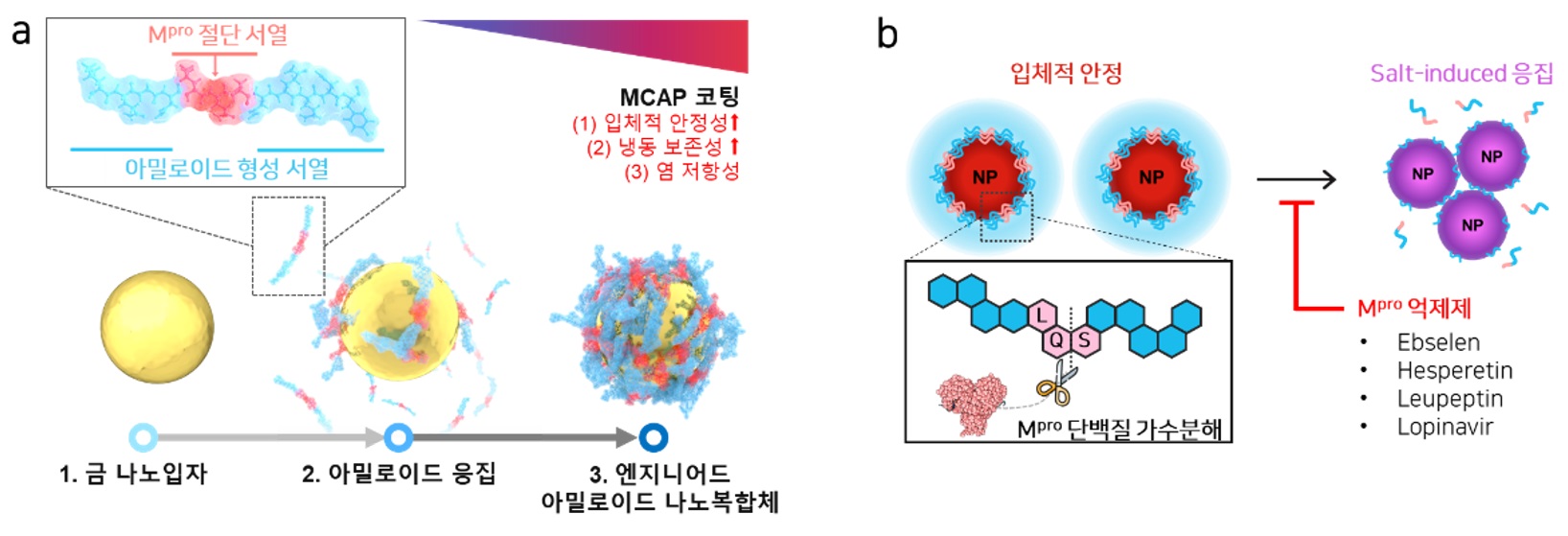
▲ (a) 엔지니어드 아밀로이드 나노복합체 합성 모식도. (b) 약물 스크리닝 모식도
연구팀은 이처럼 Mpro 활성에 따라 바뀌는 엔지니어드 아밀로이드 나노복합체 용액의 색 변화를 UV-vis 분광계로 측정함으로써, Mpro 억제제의 효능을 정량적으로 측정할 수 있는 Mpro 억제제 비색법 약물 스크리닝 플랫폼을 개발했다. 또한, 기존 Mpro를 억제하는 것으로 알려진 4종의 약물을 이용하여 플랫폼의 작동성을 검증했다. (그림 4)
<그림 설명_4>

▲ Mpro 억제제를 이용한 연구팀의 스크리닝 플랫폼 작동성 검증
해당 결과를 통하여 본 연구팀에서 개발한 스크리닝 플랫폼은 기존 형광을 이용하여 측정하는 방식에 비해 매우 고가인 Mpro를 50배 적은 농도로 사용하며, 측정의 오차도 훨씬 적음을 증명했다. 측정 시간도 1~2시간 내에 측정할 수 있어 기존 방식 대비 1/20-1/100 수준으로 고속 대용량 스크리닝이 가능하다. 또한, 본 연구팀의 플랫폼은 복잡한 전처리 과정이 필요로 하지 않음으로 비전문가도 충분히 실험을 진행할 수 있다. 이는 기존 형광 및 세포를 이용한 방식에 비해 매우 효율적이고 경제적으로 약물을 스크리닝할 수 있는 방식이라 할 수 있다.
본 연구는 한국연구재단 중견연구자지원사업 (NRF-2022R1A2C1091756), 바이오의료개발사업 (No.2023M3E5E3080743), BK21 정밀보건과학융합교육연구단의 지원을 받아 수행됐다.